哺乳动物细胞基质(如Vero、MDCK)已成为现代疫苗工业的重要生产平台。从狂犬病、脊灰灭活疫苗,到流感、轮状病毒疫苗,它们在速度、产能、抗原一致性等方面具备天然优势。
然而,细胞基质带来的宿主细胞残留DNA(residual Host Cell DNA, rHCD)仍是全球监管机构最为关注的质量控制之一。在FDA、WHO以及各国药典中,rHCD管控不仅要求残留总量达标,更强调DNA片段大小(Size)与潜在风险的关联。特别是在Vero、MDCK这类非肿瘤来源但具一定转化潜能的连续细胞系中,大片段DNA(>200 bp)可能携带癌基因或病毒基因,成为潜在致瘤与感染风险的重要来源。
基于这一监管趋势,湖州申科开发了一整套“总HCD + Size”双重检测体系,包括qPCR HCD定量方法、qPCR Size分析方法、毛细管电泳(CE)片段检测方法,帮助企业在疫苗纯化工艺验证中更系统、更精细地控制残留DNA风险,确保工艺一致性。
Vero、MDCK等连续细胞系:rHCD为何成为监管关注重点?
连续细胞系的优势在于产量高、稳定性好,但其DNA中可能包含:高拷贝癌基因(如ras、myc),潜在整合的病毒基因组片段,具有免疫刺激能力的CpG区段。有关rHCD的核心风险主要为:
• 潜在致瘤风险(Tumorigenicity)
大片段DNA更可能携带完整的致瘤基因,因此,越小的片段风险越低,通常 <200 bp被认为难以提供完整功能基因。
• 潜在感染风险(Infectivity)
部分动物细胞可能携带潜伏病毒,其基因组若未充分破碎,仍有理论上的感染可能。
• 潜在免疫刺激风险(Immunogenicity)
CpG富集区域可被TLR9识别,诱发不必要的免疫反应。
因此,WHO建议在评估用工程细胞生产疫苗时,残留HCD应纳入三个考量因素:
① 生产过程中残留HCD总量的减少情况
② 生产过程中残留HCD片段大小的降低情况
③ 生产过程中残留HCD生物活性的化学灭活情况
rHCD片段管控:Size <200 bp为何是判断标准?
FDA在其指南《Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications》中表述了一段功能性基因至少需要约200 bp片段。如果将DNA片段降解为200 bp以下,其将失去携带完整原癌基因的能力,无法维持潜在病毒基因组结构,显著降低理论致瘤和感染概率。因此,Vero、MDCK等细胞系在疫苗生产中,rHCD片段大小控制已成为监管与工艺验证的重要指标。
|
机构 |
rHCD size要求 |
| WHO | 评价DNA降解程度纳入安全模型 |
| 中国药典 | 强调片段大小与生物活性降低的关系 |
| 欧洲药典 | 对连续细胞系疫苗要求DNA片段必须显著降低 |
| FDA | 建议控制在<200bp |
rHCD全流程管控体系:从提取,qPCR检测,Size分析到风险评估
湖州申科结合客户需求与法规要求,提供覆盖从工艺样品到成品的全流程HCD风险评估解决方案:
• 样品前处理与核酸提取优化:
疫苗生产过程中具有典型抑制因素,包括了高盐,针对病毒灭活的BPL,血清蛋白、多糖,以及高浓度抗原。
SHENTEK®宿主细胞残留DNA样本前处理试剂盒针对Vero、MDCK等生产工艺进行了大量抑制适用性评估,搭建了高回收、低抑制的提取体系。
• HCD检测:
qPCR定量(灵敏度可至fg级):
- 多位点设计,避免漏检;
- 全面验证,药典推荐方法,可满足中国药典、USP、EP要求;
- 可满足纯化工艺验证(如TFF、酶切、层析),工艺一致性评价,以及过程和成品放行等。
• HCD Size:qPCR和CE双体系检测分析
① 湖州申科自主开发了首个商业化的HCD片段分析检测qPCR试剂盒,设计4–5个不同扩增子,覆盖80–100 bp,150–200 bp,200–300 bp,> 500 bp。检测灵敏度高,可达fg级,定量检测,检测数据可以直接用于风险评估模型;适用于疫苗生产的各个工艺段样品。可用于:
- 精确定量片段分布
- 工艺前后Size比较
- 阐明酶切、灭活效能
- 生成可直接用于申报的Size风险报告
② 基于毛细管电泳,开发了CE Size的测试服务平台:其数据可视化,可直接展示峰型变化,对于核酸片段残留趋势可直观呈现。可用于:
- 工艺研发、优化
- 可视化报告输出
- 复核确认
此外,湖州申科可为用户同时提供qPCR + CE双方法,使客户在申报文件中更具说服力。
• 风险评估:
结合安全系数(Safety Factor, SF)模型。
WHO将安全系数定义为DNA生物活性降低的倍数因子,该指标可用于监测生物制品中外源因子的清除和(或)去除,SF越大则被测试对象的生物安全性越高。
FDA将安全系数定义为风险的倒数。例如,若某事件的安全系数大于107,意味着该事件发生的预期风险低于1/107,即千万分之一)。
2005年,疫苗及相关生物制品咨询委员会(Vaccines and Related Biological Products Advisory Committee,VRBPAC)认为,对于采用致瘤性细胞生产的灭活流感疫苗而言,107或更高的安全系数提供可接受的安全边际。
Harry Yang等提出了一种将Benzonase酶灭活步骤考虑在内的安全系数概率模型,能够更精准地评估生物制品中残留DNA的致瘤性和传染性风险。
文献表明,HCD残留量越低、片段越小,则生物制品的安全系数越高。
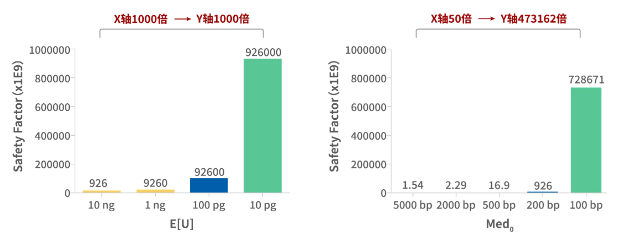
图1 HCD残留量对安全系数的线性影响和HCD残留片段大小对安全系数的指数影响
• Benzonase酶工艺下MDCK HCD片段分析
MDCK细胞基质流感疫苗纯化工艺包括对离心后的病毒收获液进行酶处理、超滤、一步层析、病毒灭活及验证、离子交换层析等步骤。通过qPCR和CE检测评估Benzonase酶切工艺在清除HCD上的效率。
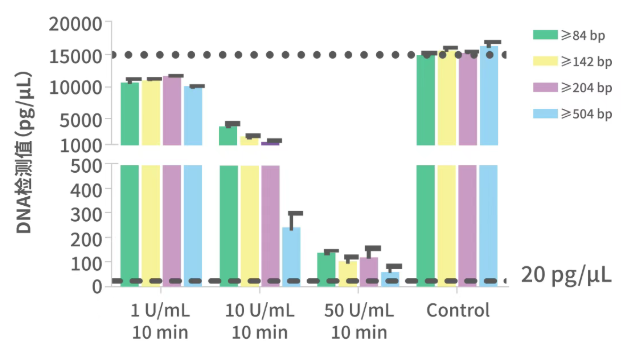
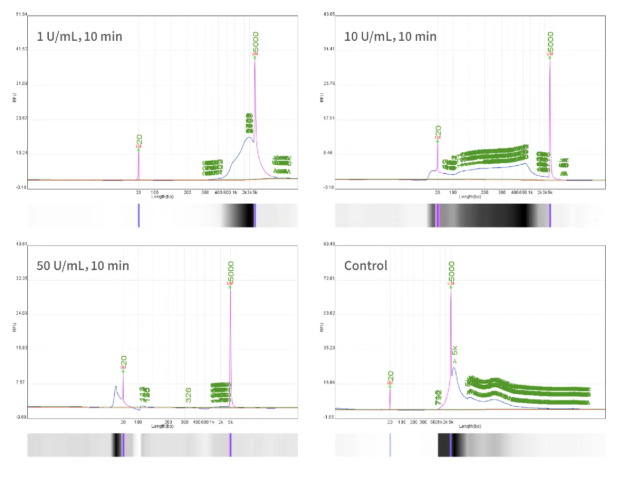
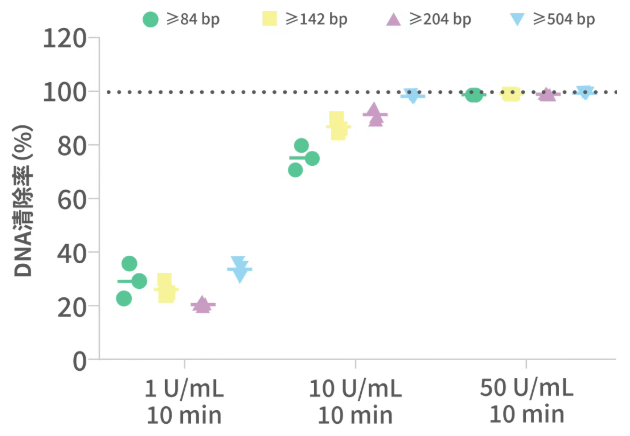
图2 Benzonase酶处理样品HCD qPCR、CE检测和HCD清除率趋势图
从“单一的总量检测”到“总量检测+Size分析+风险模型的系统化管理”是疫苗HCD残留量控制策略。
通过构建标准化qPCR方法,片段大小Size检测体系,CE可视化分析,风险评估模型(SF),工艺适用性验证,形成体系化的HCD控制策略,实现从研发、中试到商业化生产的工艺一致性与申报合规性,保障疫苗质量。
【参考文献】
[1] Yang, H., Zhang, L., Galinski, M., A probabilistic model for risk assessment ofresidual host cell DNA in biological products. Vaccine 2010, 28 (19), 3308-3311.
